湖南省科技信息研究所 www.hninfo.org.cn 时间:2019月03月12日 [字体: 大 中 小 ]
一、基本情况
瑞戈非尼是一种新型的多激酶抑制剂,瑞戈非尼是由拜耳研究并于2011年由拜耳和美国生技制药公司联合开发,拜耳与生技制药公司达成协议,按照协议,生技制药公司接管瑞戈非尼在肿瘤领域的全球销售网络。瑞戈非尼通过抑制多种蛋白质激酶,靶向作用于肿瘤生成、肿瘤血管发生和肿瘤微环境信号传导的维持。临床前研究中,已经证明瑞戈非尼抑制在肿瘤新生血管发生(新血管生长)中起重要作用的几种促血管生成的VEGF受体激酶。它还抑制几种致癌和肿瘤微环境激酶,包括KIT和PDGFR,在GIST的发生和复发中起关键作用。2012年9月27日美国食品药品监督管理局批准Stivarga(regorafenib)治疗经治疗后进展和播散至机体其他部位(转移)结肠直肠癌患者。2013年2月25日,美国食品药品管理局(FDA)批准Stivarga(regorafenib,瑞戈非尼)新适应症,用于不能通过手术切除以及使用其它已上市药物治疗无效的晚期胃肠道间质瘤(GIST)患者治疗。
|
药理作用 |
体外和体内临床前研究显示,瑞戈非尼具有广泛的抗肿瘤活性。作为多靶点的激酶抑制剂,其靶向作用涉及肿瘤血管生成和肿瘤细胞增殖的多个蛋白激酶,这些激酶包括:(1)与肿瘤血管生成相关的血管内皮生长因子受体-1(vascular endothelial growth factor receptor-1,VEGFR-1)、VEGFR-2、VEGFR-3、酪氨酸蛋白激酶受体-2(Tie-2);(2)与肿瘤细胞增殖相关的原癌基因c-Kit、酪氨酸蛋白激酶受体RET、原癌基因c-RAF、丝氨酸/苏氨酸蛋白激酶B(BRAF)丝裂原激活的蛋白(mitogen activated protein,MAP)激酶p38;(3)与肿瘤微环境相关的血小板衍生生长因子受体-β(platelet derived growth factor receptor-β,PDGFR-β)、成纤维细胞生长因子受体-1(fibroblast growth factor receptor-1,FGFR-1)。瑞戈非尼通过阻断和抑制上述激酶的活性,发挥阻断肿瘤血管生成和抑制肿瘤细胞增殖的多重抗肿瘤作用。 |
|
药动学 |
瑞戈非尼单剂量160mg口服后中位浓度达峰时间(Tmax)为4h,平均达峰浓度(Cmax)为2.5μg/ml,平均血药浓度-时间曲线下面积(AUC)为70.4μg/ml。瑞戈非尼达到稳态时,平均Cmax为3.9μg/ml,平均AUC为58.3μg*h/ml。AUC和Cmax的个体间变异率为35%-40%,平均相对生物利用度为69%-83%。瑞戈非尼体内代谢经肝肠循环,由CYP3A4和UGT1A9参与,主要代谢产物为M2(N-氧化代谢物)和M5(N-氧化和N-去甲基代谢物),在体外表现出与原形相似的药理学活性和稳态浓度。 |
|
适应证 |
经治疗后进展和播散至机体其他部位(转移)结肠直肠癌患者和不能通过手术切除以及使用其它已上市药物治疗无效的晚期胃肠道间质瘤(GIST)患者治疗 |
|
禁忌证 |
无 |
|
注意事项 |
(1)出血:对严重或威胁生命出血永久终止Stivarga。 (2)皮肤学毒性:瑞格非尼片价格中断和然后减低或终止Stivarga取决于皮肤学毒性的严重程度和持久性。 (3)高血压:对严重或不能控制的高血压暂时或永久终止Stivarga。 (4)心脏缺血和梗死:拒给Stivarga对新或急性心脏缺血/梗死和只有急性缺血事件解决后恢复。 (5)可逆性后部白质脑病综合征(RPLS):终止Stivarga。 (6)胃肠道穿孔或瘘管:终止Stivarga。 (7)伤口愈合并发症:瑞格非尼片哪里卖术前停止Stivarga。在伤口裂开患者中终止。 (8)胚胎胎儿毒性:可能致胎儿危害。劝告妇女对胎儿潜在风险。 |
|
不良反应 |
在针对胃肠道间质瘤的临床试验中,接受瑞戈非尼治疗的患者与接受安慰剂治疗的患者对比,最常见药物相关不良事件(≥20%)有衰弱/疲劳、手-足皮肤反应(HFSR)、腹泻、食欲减退和摄食量减少、高血压、粘膜炎、发声困难、感染、疼痛(未另行说明)、体重减轻、胃肠和腹部疼痛、皮疹、发热和恶心。接受Stivarga的患者中最严重的不良药物反应有肝毒性、出血和胃肠穿孔。 2014年,拜耳医药保健公司发布了III期 CONCUR试验的阳性结果,这些结果评估了 204位接受标准治疗后,肿瘤仍处于进展期的转移性结直肠癌(mCRC)亚洲患者服用肿瘤药物瑞戈非尼后的疗效和安全性。治疗转移性结直肠癌,瑞戈非尼组患者出现的最常见的≥3级不良反应包括有手足皮肤反应(16%)、高血压(12%)、高胆红素血症(12%)、肝酶水平升高(AST 10%,ALT8%)、低磷酸盐血症(9%)、贫血(7%)及高脂血症(7%)。无肝功能衰竭或胰腺炎的报道。 |
|
用法用量 |
(1)推荐剂量:160 mg口服,每天1次每28天疗程的头21天。 (2)与食物服用Stivarga(一种低脂肪早餐)。 |
|
药物相互作用 |
(1)强CYP3A4诱导剂:避免强CYP3A4诱导剂。 (2)强CYP3A4 抑制剂:避免强CYP3A4 抑制剂。 |
二、市场现状及前景
1、全球市场
瑞戈非尼2012年被美国FDA批准的后,销售额不断增长。预计近几年将持续增长,2017年以后进入相对平稳期。
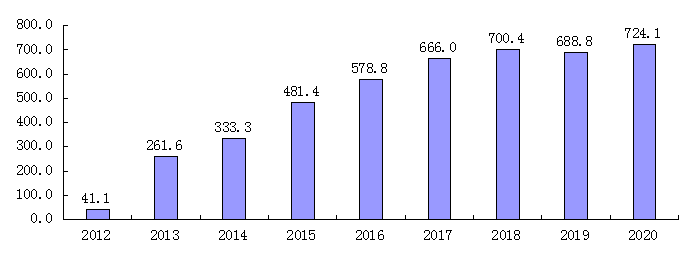
图 瑞戈非尼全球市场销售额变化柱状图
2、国内市场
目前,瑞戈非尼还没有在中国上市,但原研公司拜耳公司申请的瑞戈非尼进口片剂已于2013年获得批件。
我国GIST患者约有3万人。发生因素目前尚不十分明了,可能与胃体和肠道的长期溃疡有关,且向器官的腔外生长,故GIST在早中期没有明显症状和体征,病程较为隐秘,多无特异性症状。初次确诊时有15%-50%的GIST患者已进入晚期(高度恶性),并且15%的GIST患者已经有了转移。
结肠癌是指结肠粘膜上皮在环境或遗传等多种致癌因素作用下发生的恶性病变,发达国家发病率高于发展中国家,近几年我国结直肠癌发病率快速上升有赶超胃癌的趋势,新发病例每年超过30万例。结直肠癌相对肝癌、肺癌等进展慢,生存期长。结直肠以手术为首选治疗,化疗和靶向药物治疗也是重要的治疗手段。由于结直肠癌可选治疗药物不太多,是奥沙利铂,卡培他滨及伊立替康争夺的重要的市场。
三、竞争现状
(1)审批注册情况
目前共有9家企业有瑞戈非尼产品相关注册与受理数据,其中仅有原研公司拜耳医药获得生产许可,由于瑞戈非尼还没有在我国上市,因此,所有在审企业申请的均为新药。
在审的剂型主要有是3.1类原料药、3.1类片剂。其中,3.1类原料药:连云港润众制药、江苏豪森医药集团连云港宏创医药;3.1类片剂:正大天晴药业、江苏豪森药业;同时申请3.1类原料药和3.1类片剂:杭州朱养心药业、齐鲁制药、石药集团中奇制药技术(石家庄)有限公司、四川科伦药物研究院有限公司。详情见下表:
|
审批状态 |
企业及剂型 |
|
已发批件 |
拜耳医药保健有限公司:进口片剂 |
|
在审 |
拜耳医药保健有限公司:进口片剂 正大天晴药业集团股份有限公司:3.1类新药片剂 杭州朱养心药业有限公司:3.1类新药原料药、3.1类新药片剂 连云港润众制药有限公司:3.1类新药原料药 齐鲁制药有限公司:3.1类新药原料药、3.1类新药片剂 石药集团中奇制药技术(石家庄)有限公司:3.1类新药原料药、3.1类新药片剂 江苏豪森医药集团连云港宏创医药有限公司::3.1类新药原料药 江苏豪森药业股份有限公司:3.1类新药片剂 四川科伦药物研究院有限公司:3.1类新药原料药、3.1类新药片剂 |
四、专利现状
1.原研公司专利情况
根据数据库的检索,原研公司共有24项达拉菲尼相关专利申请,其中涉及组合物专利有9件,相关的剂型专利5件,产品专利5件,新用途专利2件,制备方法专利1件。
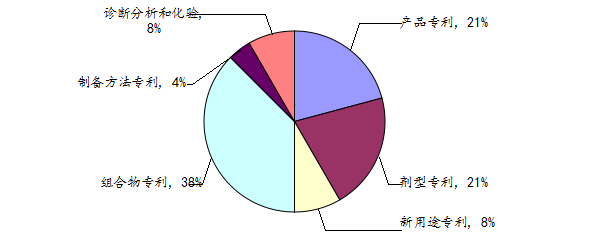
原研公司瑞戈非尼相关专利从2000年开始申请,2004-2013年基本上每年都有申请专利,其中1件于2020年到期,1件于2024年到期,5件于2026年到期,3件于2026年到期,2件于2028年到期,1件于2029年到期,5件于2031年到期,1件于2032年到期,4件于2033年到期。
2.国内专利情况
(1)专利整理情况分析
通过国家知识产权局专利数据库,检索到27件瑞戈非尼产品相关专利,27件均为发明专利。
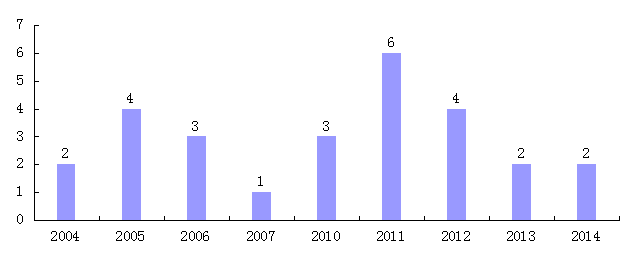
从专利申请时间来看,国内2004年开始出现瑞戈非尼产品相关专利布局,诺华公司在我国布局了14件瑞戈非尼专利,要涉及瑞戈非尼化合物、制备方法、组合物等方面。我国内企业及研究机构的相关专利从2010年开始,主要布局近5年,由于发明专利申请公开有18个月延迟,因此2013、2014年的数据经供参考。
从法律状态来看:27件专利中有4件失效,6件专利权有效,15件实质审查阶段,2件发明公开阶段。

失效的4件专利中,全部都是拜耳公司的,2件为适应症专利,2件为组合物专利。
|
申请(专利)号 |
专利名称 |
申请日 |
法律状态 |
申请(专利权)人 |
|
CN200680050664.2 |
治疗肺动脉高血压的二芳基脲 |
2006-10-30 |
失效专利 |
拜耳医药保健股份公司 |
|
CN200680041808.8 |
用于治疗糖尿病性神经病的二芳基脲 |
2006-11-09 |
失效专利 |
拜耳医药保健股份公司 |
|
CN200680018517.7 |
用于癌症治疗的包括二芳基脲化合物和PI3、AKT激酶或mTOR抑制剂(雷帕霉素类)的组合治疗 |
2006-05-13 |
失效专利 |
拜耳医药保健股份公司 |
|
CN200580037151.3 |
用于治疗过度增生性疾病的包含4-(4-(3-(4-氯-3三氟甲基苯基)-脲基)-3-氟苯氧基)-吡啶-2-羧酸的新药物组合物 |
2005-08-29 |
失效专利 |
拜耳制药公司 |
从专利权人来看,目前参与瑞戈非尼产品研究并进行专利布局的机构有11家,专利数量申请最多的为原研公司拜耳,其次为苏州泽璟生物制药有限公司申请了4件专利,其余机构都只有1件专利的申请。
|
企业名称 |
专利数 |
企业名称 |
专利数 |
|
拜尔保健公司 |
14 |
苏州麦迪仙医药科技有限公司 |
1 |
|
苏州泽璟生物制药有限公司 |
4 |
江苏集贤绿色化学科技研究院有限公司 |
1 |
|
齐鲁制药有限公司 |
1 |
翔真生物科技股份有限公司 |
1 |
|
上海医药工业研究院 |
1 |
药源药物化学(上海)有限公司 |
1 |
|
苏州晶云药物科技有限公司 |
1 |
张家港威胜生物医药有限公司 |
1 |
|
中国医学科学院药物研究所 |
1 |
|
|
(2)拜耳公司中国专利申请情况
分析发现,拜耳公司共有14件瑞戈非尼相关专利,其化合物专利将于2024年过期,另外还有2件专利与2025年过期,1件于2027年过期,6件专利处于实质审查阶段,4件专利失效。
|
申请(专利)号 |
专利名称 |
申请日 |
法律状态 |
申请(专利权)人 |
|
CN201410248545.4 |
制备4-{4-[({[4-氯-3-(三氟甲基)苯基]氨基}羰基)氨基]-3-氟苯氧基}-N-甲基吡啶-2-羧酰胺、其盐和一水合物的方法 |
2011-04-08 |
实质审查 |
拜尔健康护理有限责任公司 |
|
CN201180019150.1 |
制备4-{4-[({[4-氯-3-(三氟甲基)苯基]氨基}羰基)氨基]-3-氟苯氧基}-N-甲基吡啶-2-羧酰胺、其盐和一水合物的方法 |
2011-04-08 |
实质审查 |
拜耳制药股份公司 |
|
CN200780037680.2 |
4-[4-({[4-氯-3-(三氟甲基)苯基)]氨基甲酰基}氨基)-3-氟苯氧基]-N-甲基吡啶-2-甲酰胺一水合物 |
2007-09-29 |
有效专利 |
拜耳先灵制药股份公司 |
|
CN200580040775.0 |
BAY43-9006甲苯磺酸盐的热力学稳定形式 |
2005-09-20 |
有效专利 |
拜耳医药保健股份公司 |
|
CN200580037368.4 |
制备4-{4-[({[4-氯-3-(三氟甲基)苯基]氨基}羰基)氨基]苯氧基}-N-甲基吡啶-2-甲酰胺的方法 |
2005-09-20 |
有效专利 |
拜耳医药保健股份公司 |
|
CN200480021091.1 |
用于治疗和预防疾病和疾病症状的氟代ω-羧芳基二苯基脲 |
2004-07-22 |
有效专利 |
拜尔医药品股份有限公司 |
|
CN201210293490.X |
用于治疗和预防疾病和疾病症状的氟代ω-羧芳基二苯基脲 |
2004-07-22 |
实质审查 |
拜耳医药保健有限责任公司 |
|
CN201280042504.9 |
含有瑞格非尼的局部眼用药物组合物 |
2012-06-26 |
实质审查 |
拜尔健康护理有限责任公司 |
|
CN201210280720.9 |
用于治疗过度增生性疾病的药物组合物 |
2005-08-29 |
实质审查 |
拜尔保健公司 |
|
CN201180057294.6 |
包含取代的N-(2-芳基氨基)芳基磺酰胺的组合 |
2011-09-29 |
实质审查 |
拜耳知识产权有限责任公司 |
|
CN200680050664.2 |
治疗肺动脉高血压的二芳基脲 |
2006-10-30 |
失效专利 |
拜耳医药保健股份公司 |
|
CN200680041808.8 |
用于治疗糖尿病性神经病的二芳基脲 |
2006-11-09 |
失效专利 |
拜耳医药保健股份公司 |
|
CN200680018517.7 |
用于癌症治疗的包括二芳基脲化合物和PI3、AKT激酶或mTOR抑制剂(雷帕霉素类)的组合治疗 |
2006-05-13 |
失效专利 |
拜耳医药保健股份公司 |
|
CN200580037151.3 |
用于治疗过度增生性疾病的包含4-(4-(3-(4-氯-3三氟甲基苯基)-脲基)-3-氟苯氧基)-吡啶-2-羧酸的新药物组合物 |
2005-08-29 |
失效专利 |
拜耳制药公司 |
(3)国内其它企业专利申请情况
除了原研公司,苏州泽璟生物制药有限公司、齐鲁制药有限公司、苏州晶云药物科技有限公司、苏州麦迪仙医药科技有限公司、江苏集贤绿色化学科技研究院有限公司、翔真生物科技股份有限公司、药源药物化学(上海)有限公司、张家港威胜生物医药有限公司等企业在我国进行了专利布局。苏州泽璟生物制药在制备方法和晶型方面都有专利布局,其他企业的专利均为制备方法专利。
|
申请(专利)号 |
专利名称 |
申请日 |
法律状态 |
申请(专利权)人 |
|
CN201410181182.7 |
瑞戈非尼盐及其晶型、制备方法 |
2014-04-30 |
实质审查 |
药源药物化学(上海)有限公司 |
|
CN201010174968.8 |
抗癌用化合物及制备方法 |
2010-05-18 |
有效专利 |
苏州麦迪仙医药科技有限公司 |
|
CN201010212039.1 |
索拉非尼的制备方法 |
2010-06-29 |
实质审查 |
翔真生物科技股份有限公司 |
|
CN201310680620.X |
一种索拉非尼的合成方法 |
2013-12-12 |
实质审查 |
江苏集贤绿色化学科技研究院有限公司 |
|
CN201180014388.5 |
含氟的氘代二苯基脲的合成方法 |
2011-03-17 |
有效专利 |
苏州泽璟生物制药有限公司 |
|
CN201310349858.4 |
一种索拉非尼的优化合成方法 |
2013-08-13 |
实质审查 |
张家港威胜生物医药有限公司 |
|
CN201210249796.5 |
氘代ω-二苯基脲或其盐的多晶型物 |
2012-07-18 |
公开发明 |
苏州泽璟生物制药有限公司 |
|
CN201210143861.6 |
含氟的氘代ω-二苯基脲或其盐的多晶型物 |
2012-05-10 |
公开发明 |
苏州泽璟生物制药有限公司 |
|
CN201410059969.6 |
含氟的氘代二苯基脲的合成方法 |
2011-03-17 |
实质审查 |
苏州泽璟生物制药有限公司 |
|
CN201210349476.7 |
索拉非尼的晶型A及其制备方法 |
2012-09-19 |
实质审查 |
齐鲁制药有限公司 |
|
CN201410043637.9 |
几种新晶型及其制备方法 |
2014-01-29 |
实质审查 |
苏州晶云药物科技有限公司 |
对于上表中的专利,企业需要对其专利技术进行解析,并进行规避设计,同时可以进行自身专利布局。
(4)研究机构专利申请情况
上海医药工业研究院和中国医学科学院药物研究所在瑞戈非尼有相关专利成果,但两家机构申请的专利均处于实质审查阶段。
|
申请(专利)号 |
专利名称 |
申请日 |
法律状态 |
申请(专利权)人 |
|
CN201110129115.7 |
邻吡啶酰肼衍生物及其制法和药物组合物与用途 |
2011-05-18 |
实质审查 |
中国医学科学院药物研究所 |
|
CN201010146597.2 |
索拉非尼的制备方法 |
2010-04-14 |
实质审查 |
上海医药工业研究院 |
五、研发建议
有利因素:CORRECTIII期研究显示,治疗转移性结直肠癌总生存率提高29%(CRC,6.4个月与5个月);在KRAS野生型和KRAS突变的CRC肿瘤均可以改善存活率;GRIDIII期试验显示,改善胃肠道间质瘤(GIST)患者的PFS(从0.9到5.8个月);肾细胞癌(RCC)患者稳定率为42%,27%的患者部分缓解;I期临床研究HCC疾病控制率为72%;针对血管生成,基质和致癌受体酪氨酸激酶轮廓分明;在GIST的孤儿药地位;口服,每日给药一次;美国专利2029到期。
不利因素:如果适用,仅限于三线治疗失败化疗的CRC,抗-VEGF和抗EGFR;CORRECT实验显示,患者生活品质和健康状况的恶化,Stivarga和安慰剂没有区别;仅限于GIST三线治疗;GRID研究中,胃肠间质瘤的的总生存期无差异;继在临床计划中肝功能衰竭的重症和死亡病例,治疗中必须至少前3个月进行一次肝脏监测,伴有肝毒性黑框警告;整个治疗中,腹泻的发病率持续在18〜26%;93%的患者发生中毒事件,以及54%的患者伴有3/4级不良事件,包括手足皮肤反应、皮疹、疲劳和肾功能衰竭。
机遇:基于药物的资料分化,它的目标就是细胞增殖和肿瘤血管;立即摄取转移性CRC在所有治疗被批准后已经进展,这是缺乏有效的临床管理办法,特别是对抗EGFR治疗没有反应的KRAS突变患者;与作为二线治疗的FOLFIRI化疗结的II期临床试验中,CRC治疗方案逆向移动;CRC是全球癌症死亡的第二大原因,是一个大型的商机;30%以上的患者在确诊时就出现了转移,基本上排除了手术治疗;Gleevec和Sutent治疗后的GIST患者治疗方案的选择有限; GIST患者中,20%对格列卫无反应,50%产生耐药性;具有较高的商业价值的非小细胞肺癌和肝癌计划正在进行。
竞争威胁:行动的宽泛机制很可能意味着缺少个性化治疗的能力;毒性特征会让人望而却步,尤其是没有分子标志物来确定患者生存期的,这将证明其副作用;转移性结直肠癌的新化疗药物和靶向治疗以及他们引入临床实践的管理创新显著改善了转移性CRC结果,并提供一系列的一线和二线治疗的选择;与根深蒂固的靶向药物易瑞沙和特罗凯相比,可持续发展的定位需要占领CRC的市场份额;伴随着消费者和销售者对该区别的负面看法,有诉讼案指出,Nexavar与Stivarga不易分别将在Stivarga上市的道路上增加不必要的阻碍,销售这两种产品都将需要一个深思熟虑的商业计划,以避免相互矛盾的信息;GIST的发病率非常低;格列卫是一个十分强大的对手,2年后,90%的病人仍然生存,没有疾病进展;随着多吉美有望在短期内占据主导地位,HCC领域的竞争正在开展,目前许多后期的靶向治疗方法提供了潜在的长期的竞争;RCC领域竞争十分激烈,辉瑞的Sutent作为一线药物巩固了其首选地位,其他治疗方案也接踵而至,诺华的Afinitor、罗氏的Avastin和葛兰素史克的Votrient从2007年开始都已经入RCC市场;与多吉美结构相似,仅因为一个氟原子不同,开处方者可能更不太愿意使用它。
瑞戈非尼是由拜耳公司开发,2012年获FDA批准治疗经治疗后进展和播散至机体其他部位(转移)结肠直肠癌患者,2013年获批用于不能通过手术切除以及使用其它已上市药物治疗无效的晚期胃肠道间质瘤(GIST)患者治疗。目前,该药品还未在中国上市,但拜耳公司已开始相关药品申报,且瑞戈非尼进口片剂已于2013年获得批件,8家国内企业正在进行相关药品的申报。原研公司化合物专利将于2024年过期,可进行产学研合作的机构少。
获取报告全文请联系湖南省科学技术信息研究所:0731-84586764

