湖南省科技信息研究所 www.hninfo.org.cn 时间:2019月03月01日 [字体: 大 中 小 ]
一、基本情况
依维莫司由瑞士诺华公司最先研制开发,有片剂和分散片等剂型。商品名Certican。2003年首次在瑞典上市,在2006年已全面占领欧洲市场。除了肾细胞癌,依维莫司也正在进行对神经内分泌肿瘤、淋巴瘤、其他癌症以及结节性硬化症的研究,可作为单一制剂或者与现有的癌症治疗方法合用。作为研究药物,依维莫司的安全性和有效性还没有在肿瘤领域完全建立起来,现在正处于严格控制和监测进行的临床试验阶段。这些试验的设计是为了更好地理解该化合物的潜在效益以及相应的风险。由于临床试验的不确定性,现在还不能确保依维莫司可以作为肿瘤适应症的药品在全球范围商业出售。
近日,美国食品药品监督管理局将依维莫司(Zortress,诺华制药)列入不良事件报告系统(FAERS),因为新的安全信息显示该药可有引发肺动脉高压的潜在风险。
|
药理作用 |
依维莫司是一种mTOR的抑制剂(雷帕霉素哺乳动物靶点),PI3K/AKT通路下游的一种丝氨酸苏氨酸激酶。在几种人癌中mTOR失调控。依维莫司结合至细胞内蛋白,FKBP-12,导致一种抑制剂性复合物形成和mTOR激酶活性的抑制。依维莫司减低S6核糖体蛋白激酶(S6K1)的活性和真核生物延伸因子4E-结合蛋白(4E-BP), mTOR的下游效应器,涉及蛋白质合成。此外,依维莫司抑制缺氧-可诱导因子的表达(如HIF-1)和减低血管内皮生长因子(VEGF)的表达。在体外和/或体内研究中通过依维莫司mTOR的抑制作用曾显示减低细胞增殖,血管生成和葡萄糖摄取。 |
|
药动学 |
吸收:在晚期实体瘤患者中,从5 mg至70 mg剂量范围口服给药后1至2小时达到峰依维莫司浓度。单次给药后,5 mg和10 mg间Cmax是剂量-正比例。剂量20 mg和更高, Cmax增加是小于剂量-正比例,然而AUC跨越5 mg至70 mg剂量范围显示剂量-正比例性。每天1次给药后2周内达到稳态。 食物影响:根据数据健康受试者服用1 mg 依维莫司片,高脂肪餐减低Cmax和AUC分别为60%和16%。用AFINITOR 5 mg和10 mg片不能得到资料。 分布:依维莫司的血-血浆比例,跨越5至5000 ng/mL范围是浓度-依赖性为17%至73%。在癌症患者给予AFINITOR 10 mg/day,血浆约为观察的血浓度到20%,限制依维莫司的量。在健康受试者和中度肝损伤患者中血浆蛋白结合均为约74%, 代谢:依维莫司是CYP3A4和PgP的一种底物。口服给药后,依维莫司是人血中的主要组分。在人血中已检测到依维莫司的6种主要代谢物,包括三个单羟基代谢物,2个水解开环产物,和1个依维莫司的磷脂酰胆碱结合物在毒性研究中所用的动物物种中也鉴定这些代谢物,并且显示活性比本身低约100-倍。 在体外,依维莫司竞争性抑制CYP3A4的代谢和是CYP2D6底物右美沙芬[dextromethorphan]混合抑制剂。口服剂量10 mg每天后平均稳态Cmax比在体外抑制作用的Ki-值低12-倍以上。所以,依维莫司不可能对CYP3A4和CYP2D6底物代谢影响。 排泄:在癌症患者中未曾进行专门排泄研究。接受环孢霉素[cyclosporine]患者中给予3 mg单剂量放射性标记依维莫司后,从粪中回收80%的放射性,而在尿中排泄5%。尿或粪中未检测到母体物质。依维莫司平均消除半衰期约30小时。 |
|
适应证 |
1、舒尼替尼或索拉非尼治疗失败的晚期肾细胞癌。 2、需治疗但无法根治性手术切除的伴结节性硬化的室管膜下巨细胞星形细胞瘤(SEGA)。治疗SEGA的疗效是根据SEGA的体积改变来确定的。尚未证明飞尼妥1可使SEGA患者临床获益例如改善肿瘤相关症状、延长总生存时间。 |
|
禁忌证 |
对依维莫司,对其它雷帕霉素[rapamycin]衍生物,或对辅料任何组分超敏性。 |
|
注意事项 |
(1)非-感染性肺炎:监查临床症状或放射学变化;曾发生致命性病例。通过减低剂量或停药处理直至症状解决,和考虑使用皮质甾体。 (2)感染:增加感染的风险,有些致命性。监视征象和症状,和及时治疗。 (3)口腔溃疡:口溃疡,口炎,和口粘膜炎是常见的。处理包括口腔洗涤(无酒精或过氧化物)和局部治疗。(5.3) (4)实验室检验改变:可能发生血清肌酐,血糖,和脂质的升高。还可能发生血红蛋白,嗜中性,和血小板减低。治疗前和以后定期监测肾功能,血糖,脂质,和血液学参数。 (5)免疫接种:避免活疫苗和密切接触曾接受活疫苗者。 (6)妊娠中使用:当给予妊娠妇女时可能发生胎儿危害。告知妇女对胎儿潜在危害。 |
|
不良反应 |
依维莫司不考虑因果关系时,最常见的不良反应(发生率≥30%)有口腔炎、感染、衰弱、疲乏、咳嗽和腹泻。不考虑因果关系时,最常见的3/4级不良反应(发生率≥3%)有感染、呼吸困难、疲乏、口腔炎、脱水、肺炎、腹痛和衰弱。最常见的实验室检查异常(发生率≥50%)有贫血、高胆固醇血症、高甘油三酯血症、高血糖症、淋巴细胞减少症和肌酐水平升高。最常见的3/4级实验室检查异常(发生率≥3%)有淋巴细胞减少症、高血糖症、贫血、低磷酸盐血症和高胆固醇血症。在接受Afinitor治疗的患者中还观察到由于急性呼吸衰竭引起的死亡(0.7%)、感染(0.7%)和急性肾功能衰竭(0.4%)。 |
|
用法用量 |
1、晚期肾细胞癌 每天一次,每次口服10mg,与食物同服或不同服皆可。中度肝功能损害患者,减量服用飞尼妥1,每天一次,每次口服5mg。如需同时服用中度CYP3A4抑制剂或P糖蛋白抑制剂,如红霉素、氟康唑、维拉帕米,减量服用飞尼妥1,每天一次,每次口服2.5mg,如果患者能耐受,剂量可增至每次口服5mg。如需同时服用CYP3A4强诱导剂,如利福平、苯妥英,增量服用飞尼妥1每次增加5mg最大使用剂量可达每天一次,每次20mg。 2、室管膜下巨细胞星形细胞瘤(SEGA) 初始剂量随着患者体表面积BSA的不同而不同BSA0.5m2-1.2m2初始剂量2.5mg/天BSA1.3m2-2.1m2,5mg/天,BSA≥2.2m2,7.5mg/天随后滴定剂量使血药谷浓度达到5-10ng/mL。如需同时服用中度CYP3A4抑制剂或P糖蛋白抑制剂,大约减量50%服用本药。随后的剂量需根据血药浓度监测结果(TDM)来调整。如需同时服用CYP3A4强诱导剂,加倍增量服用本药。随后的剂量需根据血药浓度监测结果TDM来调整。处理药物不良反应时,可能需要减量服用本药或中断本药治疗。 |
|
药物相互作用 |
(1)强CYP3A4抑制剂:避免同时使用。(2)中度CYP3A4和/或PgP抑制剂:如需要联用, 谨慎使用和减低AFINITOR剂量。(3)强CYP3A4诱导剂:避免同时使用。如不能避免联用,增加AFINITOR的剂量。 |
二、市场现状及前景
1、全球市场
依维莫司由瑞士诺华公司(Novartis)最先研制开发,有片剂和分散片等剂型,商品名Certican。2003年首次在瑞典上市,在2006年已全面占领欧洲市场。2012年,美国食品和药物监管局于批准了诺华制药公司依维莫司(Afinitor)的上市申请,该药物主要用于治疗一种乳腺癌。上市以来,依维莫司销售额不断增长,预计未来几年内,其销售额仍然会不断增长。
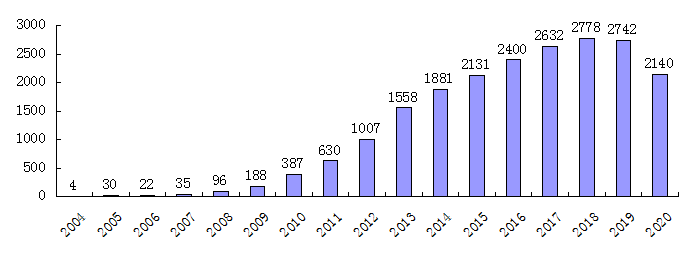
图1 依维莫司全球市场销售额变化柱状图
2、国内市场
依维莫司于2013年在中国上市,据米内网数据,依维莫司2014年样本医院年度销售额达209万元。由于专利保护,诺华公司市场份额占到100%。
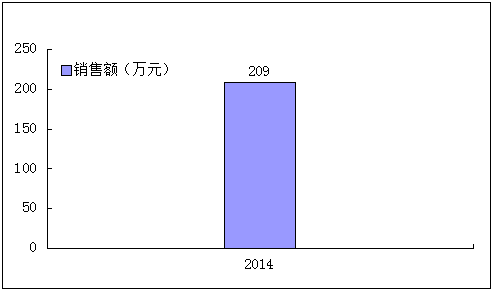
数据来源:米内网
图2 我国2014年依维莫司样本医院销售情况
三、竞争现状
(1)审批注册情况
目前共有8家企业有依维莫司产品相关注册与受理数据,其中仅有原研公司北京诺华制药有限公司获得生产许可。
在审的剂型主要有是3.1类原料药、3.1类片剂、3.4类新药和6类仿制药片剂,其中,3.1类原料药:江苏豪森、连云港润众、浙江海正、成都雅途;3.1类片剂:江苏豪森、浙江海正、山东新时代、成都盛迪、成都慧德;3.4类新药:正大天晴;6类仿制药片剂:正大天晴,详情见下表。
表1 中国依维莫司在审企业
|
审批状态 |
企业及剂型 |
|
已发批件 |
北京诺华制药有限公司:进口片剂 |
|
在审 |
江苏豪森药业股份有限公司:原料药3.1类新药、片剂3.1类新药 正大天晴药业集团股份有限公司:片剂3.4类新药、片剂6类仿制药 连云港润众制药有限公司:原料药3.1类新药 浙江海正药业股份有限公司:原料药3.1类新药、片剂3.1类的新药 山东新时代药业有限公司:片剂3.1类新药 成都盛迪医药有限公司:片剂3.1类新药 成都雅途生物技术有限公司:原料药3.1类新药 成都慧德医药科技有限公司:片剂3.1类新药 |
数据来源:药智网、SFDA
(2)企业竞争现状
现阶段,经SFDA批准许可在国内生产销售的目前只有原研公司诺华。诺华的依维莫司产品2013年在我国获得SFDA生产批件,占据我国全部用药市场。目前也没有国内企业获得该药品批件。
(3)城市竞争格局
根据米内网数据,2014年我国样本医院依维莫司市场大部分主要集中在北京,其次是广州,还有一少部分集中在杭州、南京、重庆、郑州、石家庄。
表2 依维莫司国内样本医院区域份额格局
|
城市名称 |
2014年份额 |
|
北京 |
72.32% |
|
广州 |
20.21% |
|
杭州 |
2.5% |
|
南京 |
1.77% |
|
重庆 |
1.42% |
|
郑州 |
1.07% |
|
石家庄 |
0.71% |
四、专利现状
1.原研公司专利情况
根据数据库的检索,原研公司共有47项依维莫司相关专利申请,其中涉及组合物专利有21件,相关的剂型专利有9件,新应用9件。
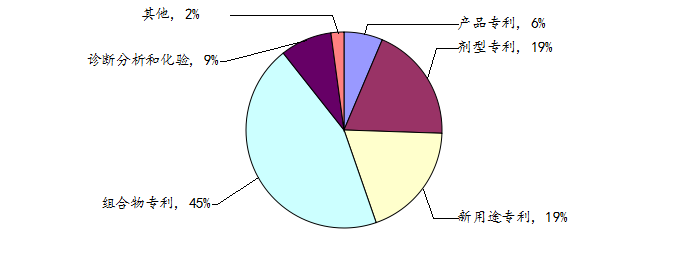
图3 诺华公司依维莫司专利申请类型比例分布图
原研公司的47件专利中,从2013年开始,基本上每年都有专利到期,具体到期时间和专利件数见下表。
表3 原研公司依维莫司相关专利到期时间表
|
专利过期时间 |
专利件数 |
专利过期时间 |
专利件数 |
|
2013 |
1 |
2024 |
4 |
|
2014 |
2 |
2025 |
2 |
|
2015 |
3 |
2026 |
8 |
|
2016 |
1 |
2027 |
5 |
|
2017 |
3 |
2030 |
1 |
|
2019 |
1 |
2031 |
3 |
|
2020 |
1 |
2032 |
3 |
|
2022 |
3 |
2033 |
1 |
|
2023 |
3 |
2034 |
2 |
2.国内专利情况
(1)专利整理情况分析
通过国家知识产权局专利数据库,检索到29件依维莫司产品相关专利,均为发明专利。
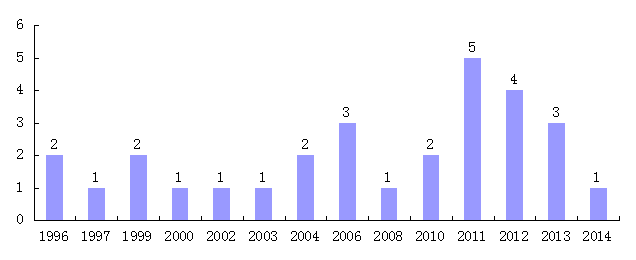
图4 国内依维莫司相关专利
从专利申请时间来看,国内1996年开始出现依维莫司产品相关专利布局,诺华公司在我国布局了7件依维莫司专利,要涉及依维莫司化合物、晶型、合成方法、制备方法等方面。我国内企业及研究机构的相关专利主要布局近4年,由于发明专利申请公开有18个月延迟,因此2013、2014年的数据经供参考。
从法律状态来看:29件专利中有6件失效、12件专利权有效,9件实质审查阶段,2件发明公开阶段。
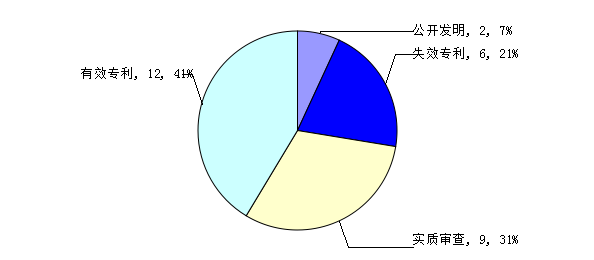
失效的6件专利中,其中3件是惠氏公司方法及合成专利。
图5国内依维莫司专利法律状态
表 4 国内依维莫司失效专利
|
申请(专利)号 |
专利名称 |
申请(专利权)人 |
|
CN00816368.5 |
雷帕霉素衍生物的区域选择性合成方法 |
惠氏公司 |
|
CN03809309.X |
含大环三烯化合物的聚合物组合物 |
太阳生物医学有限公司 |
|
CN200480005869.X |
包含雷帕霉素衍生物和芳化酶抑制剂的抗肿瘤组合 |
惠氏公司 |
|
CN200480008682.5 |
大环内酯物质的结晶与纯化 |
特瓦药厂有限公司 |
|
CN200680007467.2 |
42-O-(2-羟基)乙基-雷帕霉素的氧杂环庚烷异构体 |
惠氏公司 |
|
CN200680018517.7 |
用于癌症治疗的包括二芳基脲化合物和PI3、AKT激酶或mTOR抑制剂(雷帕霉素类)的组合治疗 |
拜耳医药保健股份公司 |
从专利权人来看,目前参与依维莫司产品研究并进行专利布局的机构有20家(含合并申请),专利数量申请较多的主要有诺华公司、惠氏公司、成都雅途、山东新时代等。
表 5 国内依维莫司专利专利分布
|
企业名称 |
专利数 |
企业名称 |
专利数 |
|
诺瓦蒂斯有限公司(诺华股份有限公司) |
7 |
上海现代制药股份有限公司; |
1 |
|
惠氏公司 |
3 |
上海现代制药海门有限公司 |
1 |
|
成都雅途生物技术有限公司 |
3 |
江苏汉邦科技有限公司 |
1 |
|
山东新时代药业有限公司 |
2 |
太阳生物医学有限公司 |
1 |
|
拜耳医药保健股份公司 |
1 |
特瓦药厂有限公司 |
1 |
|
阿里亚德基因治疗公司 |
1 |
江苏奥赛康药业股份有限公司 |
1 |
|
中国科学院上海药物研究所 |
1 |
上海医药工业研究院; |
1 |
|
东南大学 |
1 |
常州兰陵制药有限公司 |
1 |
|
浙江海正药业股份有限公司 |
1 |
罗切格利卡特公司 |
1 |
|
苏州特瑞药业有限公司 |
1 |
成都摩尔生物医药有限公司 |
1 |
(2)诺华公司中国专利申请情况
诺华公司在中国共申请了7件专利,其中4件专利将于近几年过期。诺华公司其中有2件专利将在2016年过期,1件将在2017年过期,2件在2019年过期,还有2件专利处于实质审查阶段。
表 6 诺华公司依维莫司中国专利申请
|
申请(专利)号 |
专利名称 |
申请日 |
法律状态 |
专利权人 |
|
CN96194681.4 |
雷帕霉素衍生物 |
1996-06-05 |
有效专利 |
诺瓦蒂斯有限公司 |
|
CN96196788.9 |
药物组合物 |
1996-07-12 |
有效专利 |
诺瓦蒂斯有限公司 |
|
CN97193278.6 |
雷帕霉素衍生物在血管病和异种移植中的应用 |
1997-03-26 |
有效专利 |
诺瓦提斯公司 |
|
CN99814124.0 |
大环内酯的稳定化 |
1999-12-06 |
有效专利 |
诺瓦提斯公司 |
|
CN200610079804.0 |
大环内酯的稳定化 |
1999-12-06 |
有效专利 |
诺瓦提斯公司 |
|
CN02806844.0 |
癌症的治疗 |
2002-02-18 |
实质审查 |
诺瓦提斯公司 |
|
CN201280049427.X |
包含40-O-(2-羟基)乙基-雷帕霉素的药物组合物 |
2012-10-03 |
实质审查 |
诺华股份有限公司 |
(3)国内其它企业专利申请情况
除了原研公司,惠氏公司、拜耳医药、成都雅途、山东新时代、浙江海正等国内外企业在我国进行了专利布局。其中13件专利为合成或制备方法专利,主要公司有浙江海正、成都雅途、山东新时代、成都摩尔、上海现代制药、江苏奥赛康、江苏汉邦、常州兰陵制药、上海医药工业研究院、中国科学院上海药物研究所、东南大学;2件晶型专利,主要公司有成都雅途和特瓦药厂,但后者为失效专利;5件组合物专利,主要公司有惠氏公司、拜耳医药、苏州特瑞、江苏奥赛康、太阳生物医学,其中惠氏公司、拜耳医药、太阳生物医学的专利为失效专利。
表 7其它企业依维莫司中国专利情况
|
申请(专利)号 |
专利名称 |
申请日 |
法律状态 |
专利权人 |
|
CN00816368.5 |
雷帕霉素衍生物的区域选择性合成方法 |
2000-09-27 |
失效专利 |
惠氏公司 |
|
CN03809309.X |
含大环三烯化合物的聚合物组合物 |
2003-04-24 |
失效专利 |
太阳生物医学有限公司 |
|
CN200480005869.X |
包含雷帕霉素衍生物和芳化酶抑制剂的抗肿瘤组合 |
2004-03-01 |
失效专利 |
惠氏公司 |
|
CN200480008682.5 |
大环内酯物质的结晶与纯化 |
2004-03-31 |
失效专利 |
特瓦药厂有限公司 |
|
CN200680007467.2 |
42-O-(2-羟基)乙基-雷帕霉素的氧杂环庚烷异构体 |
2006-02-22 |
失效专利 |
惠氏公司 |
|
CN200680018517.7 |
用于癌症治疗的包括二芳基脲化合物和PI3、AKT激酶或mTOR抑制剂(雷帕霉素类)的组合治疗 |
2006-05-13 |
失效专利 |
拜耳医药保健股份公司 |
|
CN200680051034.7 |
对癌症病人给药mTOR抑制剂 |
2006-11-14 |
有效专利 |
阿里亚德基因治疗公司 |
|
CN201010546471.4 |
无定形依维莫司及其制备方法 |
2010-11-17 |
有效专利 |
浙江海正药业股份有限公司 |
|
CN201110055086.4 |
依维莫司的纯化方法 |
2011-03-09 |
有效专利 |
成都雅途生物技术有限公司 |
|
CN201110065075.4 |
一种依维莫司固体口服药物组合物 |
2011-03-17 |
有效专利 |
苏州特瑞药业有限公司 |
|
CN201180018255.5 |
无岩藻糖基化CD20抗体与mTOR抑制剂的联合疗法 |
2011-04-21 |
实质审查 |
罗切格利卡特公司 |
|
CN201110253059.8 |
一种依维莫司的合成方法 |
2011-08-30 |
有效专利 |
成都摩尔生物医药有限公司 |
|
CN201110356001.6 |
一种含依维莫司的片剂及其制备方法 |
2011-11-11 |
实质审查 |
山东新时代药业有限公司 |
|
CN201210168250.7 |
一种依维莫司的制备方法 |
2012-05-25 |
实质审查 |
上海现代制药股份有限公司;上海现代制药海门有限公司 |
|
CN201210292909.X |
一种含依维莫司的片剂及其制备方法 |
2012-08-17 |
公开发明 |
山东新时代药业有限公司 |
|
CN201210426492.1 |
一种依维莫司的制备方法 |
2012-10-31 |
公开发明 |
江苏汉邦科技有限公司 |
|
CN201310300794.9 |
依维莫司结晶提纯方法 |
2013-07-17 |
实质审查 |
成都雅途生物技术有限公司 |
|
CN201310300574.6 |
依维莫司杂质检测用参比标示物及其制备方法 |
2013-07-17 |
实质审查 |
成都雅途生物技术有限公司 |
|
CN201310642757.6 |
一种含依维莫司的组合物及其制备方法和含有这一组合物的药物制剂 |
2013-12-05 |
实质审查 |
江苏奥赛康药业股份有限公司 |
|
CN201410111440.4 |
依维莫司的制备工艺 |
2014-03-24 |
实质审查 |
上海医药工业研究院;常州兰陵制药有限公司 |
对于上表中的专利,企业需要对其专利技术进行解析,并进行规避设计,同时可以进行自身专利布局。
(4)研究机构专利申请情况
中国科学院上海药物研究所、东南大学、上海医药工业研究院这3个研究机构在依维莫司方面有专利成果,但都只有一件成果,其中上海医药工业研究院已经与常州兰陵制药有限公司合作。
|
申请(专利)号 |
专利名称 |
申请日 |
法律状态 |
专利权人 |
|
CN200810040879.7 |
选择性硅醚化保护雷帕霉素31位或42位羟基的新方法 |
2008-07-23 |
有效专利 |
中国科学院上海药物研究所 |
|
CN201010017955.X |
依维莫斯的制备 |
2010-01-18 |
有效专利 |
东南大学 |
|
CN201410111440.4 |
依维莫司的制备工艺 |
2014-03-24 |
实质审查 |
上海医药工业研究院;常州兰陵制药有限公司 |
(资料来源:佰腾网)
五、研发建议
有利因素:第一个受批准的治疗难治愈的肾细胞癌的药物;有三期实验数据来支持,25%的患者进一步发展至少需10个月;30年来,第一个获批的胰腺神经内分泌肿瘤药物,风险降低65%;与依西美坦单独治疗乳腺癌相比,依维莫司结合依西美坦,在治疗严重ER + / HER2-乳腺癌中改善PFS,PFS的好处也独立于先前进行荷尔蒙治疗或化疗的反应;与依西美坦相比,在同一试验中,增加Afinitor减缓骨转换;高选择性;只有直接抑制mTOR的一个族群的蛋白质;每日口服给药,不受进食影响;专利与2020年3月到期。
不利因素:目前仅被批准作为二线药物;与依西美坦单独用药相比,BOLERO-2实验中,与依西美坦联合用药未能显著改善HR+/HER2晚期乳腺癌细胞;在治疗乳腺癌上相对温和;毒性是依维莫司一大问题,且12的患者伴有肺炎,甚至出现死亡病例;口腔溃疡、口腔炎、呼吸困难、疲劳和皮疹也是常见的不良反应;有机会出现感染;未能改善在肝细胞癌(EVOLVE-1试验)且需持续给药。
机遇:在RCC上未满足临床需要,特别是在转移性疾病具有显著的复发率和低生存率;RCC发病率正在稳步增加;晚期患者生存率的改善,稍微降低复发风险的患者可能导致生活在晚期RCC患者人数增长;可能对使用一种酪氨酸激酶抑制剂(Sutent或者Nexavar)的医生具有特别有吸引力,更倾向于使用一个不同作用机制的二线药物;竞争对手Torisel在治疗RCC的一线药物(INTORACT)的实验失败,同时二线药物也失败,这将减少竞争威胁;这种疾病治疗方案非常有限,其在网络上迅速传播;诺华十分看好网络市场,因此实际上已经通过其Sandostatin市场培养内科医生,来开发此市场;依维莫司也在研发用于治疗其他类型的肿瘤,如三期试验的淋巴瘤,这是目前更大的商机;由于辉瑞并没有开发mTOR抑制剂(Torisel)治疗其他类型的晚期癌症,依维莫司至少近期内的竞争对手有限。
竞争威胁:诺华似乎并不打算以研究Afinitor的在第一线的RCC,其中Suent已经证明的疗效和安全性已使其成为首选的一线治疗方案;Inlyta被认为是与Afinitor非常相似的第二线药物,并且将作为首选药物与二线药物中的 Votrient直接竞争, Votrient预计在2018年将积极主导RCC市场,与现在的市场领导者Sutent正面交锋;随着阿瓦斯丁被批准用于治疗RCC的一线药物,医生可以选择尝试二线药物VEGF抑制剂,这可能意味着mTOR的抑制Afinitor只考虑作为最后的选择;一些肿瘤学家可能更喜欢患者使用静脉治疗而不是口服治疗;高定价可能会限制销售量,为一种口服药物,自付在美国是昂贵的,许多保险公司可以拒绝支付费用,在欧盟的成本效益评估也可以证明其很高;RCC的发病率较低,全球每年约87000病例;手术治疗仍然是局部病变的RCC患者的主要治疗方式,而且常常是有效的,大约25%的患者有IV期疾病,并且仅这些患者主要视为药物治疗的候选人;由于RCC的高层次需求未得到满足,未来将会面临相当多靶向疗法和免疫疗法的竞争,以Exelixis公司的Cometriq的为例,它已经在RCC患者预处理的小实验中产生积极的效果。比较严重的副作用和温和效果很可能意味着Afinitor很难在治疗HER2+乳腺癌获得批准,特别是罗氏Kadcyla在该领域患者卓越的疗效和耐受性;Palbociclib和ribociclib是第一个进入市场的CDK4/6抑制剂,并有望提高HR+ HER-乳腺癌患者的生存率,但其毒性比Afinitor低;仅1%至5%的胰腺肿瘤是神经内分泌的。
获取报告全文请联系湖南省科学技术信息研究所:0731-84586764

